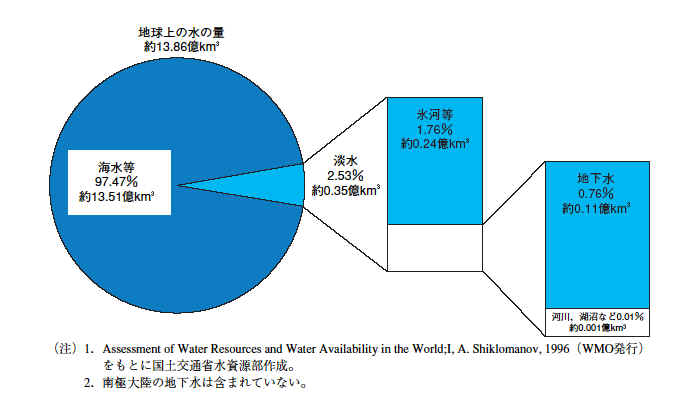
地球上の水:国土交通省白書「日本の水資源」平成16年版
http://www.mlit.go.jp/tochimizushigen/mizsei/hakusyo/h16/2-1.pdf
第5章 水の循環
1.水の循環
地球上では、水は水蒸気・水・氷の3つの形をとりうる。その大部分が海水(水)として存在している。2番目は氷河(氷)である。

地球上の水:国土交通省白書「日本の水資源」平成16年版
http://www.mlit.go.jp/tochimizushigen/mizsei/hakusyo/h16/2-1.pdf
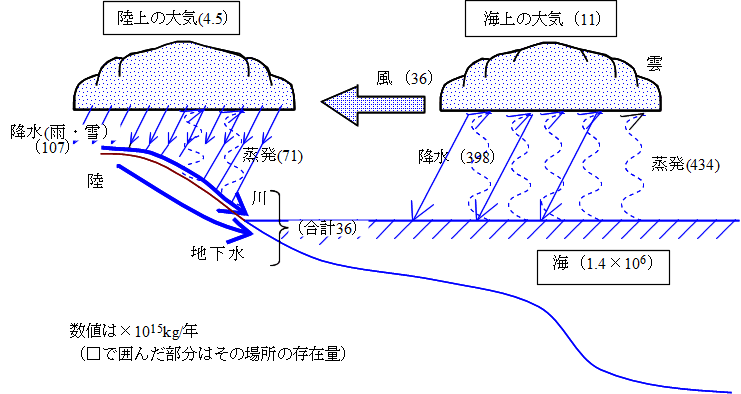
地球上の水は下図のように循環している。蒸発のエネルギー源は太陽エネルギー、高いところから低いところへの移動は重力のエネルギーということになる。海水は1.4×106(×1015)kgという量があるが、海からは434×1015kg/年の蒸発量があるので、海水は1.4×1021kg÷(434×1015kg/年)=3200年、つまり約3000年で入れ替わることになる。また大気中の水蒸気は海上+陸上(11+4.5)×1015kg=15.5×1015kgあるが、海と陸の降水量の合計は(398+107)×1015kg/年=505×1015kg/年なので、15.5×1015kg÷(505×1015kg/年)=3.07×10-2年(約11日)で入れ替わることになる。
当然のことながら、海での蒸発量434×1015kg/年と陸での蒸発量71×1015kg/年の合計505×1015kg/年は、海の降水量398×1015kg/年と陸の降水量107×1015kg/年の合計の505×1015kg/年と同じになっていて、バランスがとれていることがわかる。細かく見ると、海では蒸発量の方が降水量よりも36×1015kg/年だけ多いが、それは風によって陸に運ばれて、陸で雨・雪となって降り(陸では降水量の方が蒸発量よりも36×1015kg/年だけ多い)、結局陸に降った雨・雪は河川水・地下水として、風によって陸に運ばれている36×1015kg/年と同じ量が海に戻っている。こうして、海水の量は増えもしないし、減りもしないことになる。
ただし下の図の数値はそれほど信頼性の高いものではない。降水量を考えても、陸では観測できるが海の観測は難しい。また陸といっても、降水量は地形などの局所的条件にも大きく左右されるので、広範囲における推定は難しい。現在は、人工衛星からの観測(リモートセンシング)の発達により、より正しい蒸発量・降水量の測定が進行中である。
なお、日本の水資源の問題はこちらを参照。
「地球システム科学」(岩波地球惑星科学講座、1996年)、p120の図を簡略化
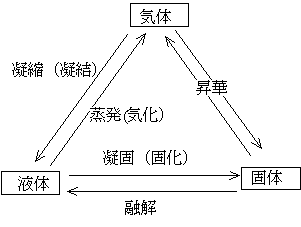
物質の三態:多くの物質は、固体(分子がきちんと並んでいる状態)、液体(分子はつながっているがきちんと並んでない状態)、気体(分子の一つ一つがバラバラに飛び回っている状態)をとることができる。その中で水(H2O)は、常温・常圧の環境(地球表面の環境)で、三態を示すまれな物質である。
それぞれの形から別の形に移ること(相変化・相転移)に対しては下図のような呼び方がある。気象関係では、水蒸気から水への相変化を凝結ということが多い。また、昇華は気体から固体に直接変わるときにも、固体から気体に直接変わるときにも用いられる。冷凍庫に入れておいた氷が自然に小さくなっていくのは、氷から水蒸気への昇華が起きているからである。タンスなどに入れておく防虫剤もそうである。寒い冬の朝などに見られる霜は、空気中の水蒸気が土・木の葉の表面に直接昇華して氷となったものである。
1気圧の条件では水(H2O)は、0℃で水(液体)と氷(固体)が共存できる。0℃よりも温度が高いと水(液体)が安定な状態、0℃よりも温度が低いと氷(固体)が安定な状態である。しかし、0℃より温度が低い状態でも水は存在している。こうした水を過冷却水という。過冷却水についてはこちらを参照。また、1気圧のとき100℃(厳密には99.974℃)で水が沸騰(水の内部からも水蒸気が発生)する。ただし、水面からの水の蒸発は100℃でなくても起きている。コップに入れておいた水が自然に減っていたり、洗濯物が乾くのはこのためである。つまり、水蒸気は100℃よりも温度が低くても(さらに0℃よりも温度が低くても)存在している。
なお、すべての物質が固体・液体・気体の三体をとるわけではない。たとえば、われわれの体を作っている有機物は(酸素がない状態で)温度を上げていくと分解してしまう(タンパク質からH(水素)やO(酸素)が水の形で抜けて(脱水)、おものC(炭素)が残る(炭化する))。だから、液体人間とか、気体人間とかはあり得ない。
また、プラスチックやゴム、ガラスなどは固体と液体の境界があいまいで。温度を上げていくとだんだんと柔らかくなり、そのうち液体になってしまう。そもそも一見硬い岩石も長時間ゆっくりゆっくり加わる力に対しては流れるという粘弾性を示すので、固体と液体の区別はある意味では難しい。
水の不思議:水は不思議な性質をたくさん持っている。そもそも上に書いたように、常温・常圧の世界で自由に三態を移り変わる物質は水以外にない。こうした水が自由に三態を移り変わることができる環境があってはじめて、生命の誕生があったのかもしれない。
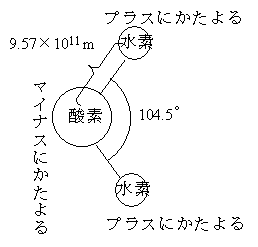
水の分子式はH2Oであるが、液体の水はH2O単独で存在しているのではない。水の分子構造は下左のような図をつくっている。つまり、水素原子と酸素原子が水分子として結合するとき、水素と酸素がお互いの一番外側を回っている電(マイナスの電荷を持っている)の一つを共有する形で結合する(共有結合)。そこで、水素の一つしかない電子は酸素側に引かれるために水素側はプラスにかたより、逆に酸素側はプラスにかたよることになる。そこで、水分子が近いところに存在していると、一つの水分子の水素と隣の水分子の酸素が、また一つの水分子の酸素と隣の水分子の水素が電気的な力で結ばれることになる。つまり、液体の水の中では、水分子は一つ一つとして存在しているのではなく、いくつかが集まったクラスターというものになっている。ただし、このクラスターは安定なものではなく、10-12秒のオーダーで生まれたり、壊れたりしている。だから、小さなクラスターを売りにしている「健康によい水」は怪しい(どうやってそのクラスターを小さいままで保持する?、そもそも小さいクラスターをどうやってつくる?)ということもわかる。
 |
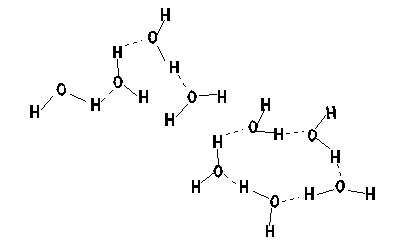 |
| 水分子の構造 | 水素結合がつくるクラスター。図の点線が水素結合。 水の話:コンプロネット http://www.con-pro.net/readings/water/doc0003.html |
この水素結合がつくるクラスターが水の不思議な性質の原因である。
こうして水分子がそれ自身の場所によって電気的にプラス・マイナスを引きつけることができることによって、いろいろなイオンを溶かし込むことができる。生物は水のこうした性質のおかげで、水を利用して栄養物・老廃物を運搬したり、また水に溶けているイオンの化学反応を利用して生命活動を行っている。
水の不思議な性質の一つは、水は固体になった方が密度が小さくなる(氷が水に浮く)。固体は分子がきちんと並んでいる状態(結晶をつくっている)ので、分子が自由に動くことができる液体よりも密度が大きくなるのがふつうである。ところが、水(液体)はこの水素結合でお互いが引き合っているので、固体の氷よりも密度が大きいのである。また、ふつうの物質は温度が高いほど、分子運動が激しくなって分子間の間隔が大きくなり、密度が小さくなる。ところが水は4℃で密度が最大になる。これも、4℃までは水素結合の力が大きいためであると考えられている。
湖水で水面が0℃、あるいは氷が張ったとしても、湖底の水は4℃であるので、湖のすむ魚は生存しやすくなる。なお、海水は0℃で氷るのでないし(約−1.8℃で氷ができ始める)、密度最大となるのも4℃ではない。これについてはこちらを参照。
これは地球環境にとっては重要な性質で、もし水が他の物質のように固体になると液体よりも密度が大きくなってしまうと、水面で冷やされてできた氷は次から次への底に沈んで、湖水や海水全部が氷ってしまうことになり、生物生存が難しくなる。実際には水面に氷ができてしまうと、氷は熱を伝えにくいのでその下は水はあまり冷えずに、水の状態のままで存在できる。どんなに気温が下がっても、水面の氷の厚さは2m程度という。ただし、流氷は氷片がたがいに衝突して重なり合ったりすることもあるので、10mくらいの厚さになることもある。なお、氷山は陸の氷河が海に流れ出たもので、1000mを越える厚さがある場合もある。氷河は、降り積もった雪が自分自身の重さでつぶれて分厚い氷になったものである。
水はまた蒸発熱(気化熱)が、同じような分子の大きさをした他の物質と比べて異常に大きい。水1mol(18g)を蒸発させるために必要なエネルギーは40.7kJであり、メタノール1mol(32g)が35.3kJ、エタノール1mol(46.1g)が38.6kJである。また沸点も1気圧(1013hPa)で、水は100℃(厳密には99.974℃)に対して、同じくメタノールは64.7℃、エタノールは78.3℃であり、沸点も高いことがわかる。これも、水は単なるH2Oではなく水素結合でクラスターをつくっており、見かけ上大きな分子となっているためである。
水+エネルギー(熱) → 水蒸気
水蒸気 → 水+エネルギー(熱)
のように、水が水蒸気となるときはまわりから熱を奪い、水蒸気が水になるときはまわりに熱を放出する。水蒸気はあたかも熱を蓄えているようなので、これを潜熱という。水蒸気が水になるときはこの潜熱を放出することになる。
また比熱も大きく、岩石の4倍、金属の10倍もある。つまり水(海)は、岩石(陸)よりもはるかに熱を蓄えることができることになる。
こうして水の潜熱や比熱が大きいことは、地球全体の気候を和らげることになる。例えば日中の強い日射によって水が蒸発するときは、まわりから熱を奪うし、逆による気温が下がればその水蒸気が水に戻るときにまわりに潜熱を放出する。このために、極端な温度の上下がない。また、暖まりにくく冷えにくい(比熱が陸よりも大きい)海があるために昼夜・季節による気温の変化も小さい(海から遠い内陸で水があまりない砂漠では昼夜の気温の差が大変に大きい)。さらに、海流、空気中の水蒸気が地球内で熱を有効に運搬している。
もう一つ、水は圧力が高いほど融点が下がるという性質もある。ふつう固体は分子がきちんと並んでいる状態なので、圧力が高いほど分子が並びやすく、つまり固体なりやすい。だから、一般には圧力が高いほどより高い温度で固体になる(凝固点が下がる)。ところが水は逆なのである。アイススケートはこれを利用している。スケート靴を履くと設置面積が狭い刃に体重がかかるので、ふつうの靴で氷の上に立つよりも高い圧力がかかることになる。このために氷が融けて水となり、その水が油のような役割を果たしてすべりやすくなる。だから、あまり温度が低い氷では、すべりにくくなる。スピードスケートで世界記録が出るようなアイススケート場は、氷の温度の管理を厳重にやっている。
ガラスの不思議:ガラスは一見固体であるが、その分子は規則正しく並んではおらず、あたかも液体のようになっている。一時、中世ヨーロッパの教会のステンドグラスは“流れ”だしていて、上よりも下の方が厚くなってきているということがいわれてたことがあるが、詳しい計測の結果これは否定された。もっとも、数万年とか数十万年という長い時間をかければ、まわりの材質(おもに石材)よりは流れやすいので、このような変形が見られるかもしれない。
なお、もう一つ、電子や陽イオンの気体をとくにプラズマといい、通常の気体とは異なった性質を示す。そこで、固体、液体、気体の三態にガラスとプラズマを加えて物質の五態という人もいる。
mol(モル):炭素(12C)0.012kg(12g)に含まれる原子の個数。これをアボガドロ数(アボガドロ定数)といい、6.0221367×1023(1969年純正国際応用化学連合総会)という数値になる。気体は、同気圧・同温度、ある体積中の分子の個数は同じ数になる(アボガドロの法則)。0℃、1気圧(1013hPa)では、1L(1リットル)の体積の気体中に含まれる分子数はアボガドロ数となる。なお、アボガドロ数や気体についてはこちらも参照。
アボガドロ:アボガドロ(Amedeo Avogadro、イタリア、1776年〜1856年)。1811年にアボガドロの法則を提唱。だが、実際にそれが受け入れられたのは、1850年代になってからである。彼はまた気体は分子からなり、その分子は原子からなっていることも提唱した。

アボガドロ:http://www.bulldog.u-net.com/avogadro/avoga.html